
电 话:18985827223
传 真:0855-8686776
邮 箱:wwli2009@126.com
网址:zchtek.com
地 址:贵州省凯里市永丰东侧迎宾大道16号
贵州省医疗器械GMP洁净室清洁度要求[标准]
为加强医疗器械生产的监督管理,规范医疗器械生产质量管理体系,根据《医疗器械监督管理条例》及有关规定,正式实施。2011年1月1日。2011年7月1日后不符合标准的企业不予注册。
《医疗器械生产质量管理标准》及其附件规定,医疗器械生产企业应当按照有关规定建立和完善质量管理体系,包括机构和人员、厂房和设施、设备、文件和管理制度。管理、设计和开发、采购、生产管理、质量控制、销售和售后服务、无合格品控制、不良事件监测、分析和改进。
以下按照GMP规范制造的医疗器械目录
要求
1.需在当地10000级以下100级洁净区加工并插入血管内的无菌医疗器械或单件包装件,如灌装、封口等,其(不洁净)件的加工,最终清洗、组装、初包装、封口等。清洁度不得低于10000级。水平。
举个例子
1.血管植入:如血管支架、心脏瓣膜、人工血管等。
2.第二步。血管介入:各种血管内导管等,如中心静脉导管、支架输送系统等。黔西地区医疗器械GMP洁净室清洁要求[标准]
3.第二步。直接或间接与血液、骨髓腔或非自然腔相连的植入人体组织的无菌医疗器械或单包装附件应在(UNC)的加工、最终清洁、组装、初始包装和密封等生产区域制造。EAN)零部件的清洁度不低于100000级。
举个例子
1.人体组织器械植入:起搏器、药物输送装置皮下植入、人工乳房等。
2.第二步。直接接触血液:血浆分离器、血液过滤器、手术手套等。
三。间接接触血液的仪器:输液器、输血器、静脉针、真空采血等。
第四章。骨接触器械:骨内器械、人工骨等。贵州省医疗器械GMP洁净室清洁度
三。接触人体受损表面和粘膜的无菌医疗器械或单包装(不洁净)部件的加工、最终清洁、组装、初包装和密封应在不低于300000级的洁净室(区)内进行。
举个例子
1.接触损伤表面:烧伤或伤口敷料、医用脱脂棉、脱脂纱布、一次性无菌手术用品,如手术垫、手术服、医用口罩等。
2.第二步。接触粘膜:无菌导管、气管插管、宫内节育器、人体润滑剂等。
第四章。直接接触无菌医疗器械表面、不经洗涤使用的初级包装材料的生产环境的清洁度等级应与产品生产环境的清洁度等级遵循相同的原则,以保证产品的质量。如果初始包装材料不符合包装无菌医疗器械的要求,初级包装材料的质量可以满足包装无菌医疗器械的要求。无菌医疗器械应在不少于30万的洁净室(区)内生产,直接接触表面。
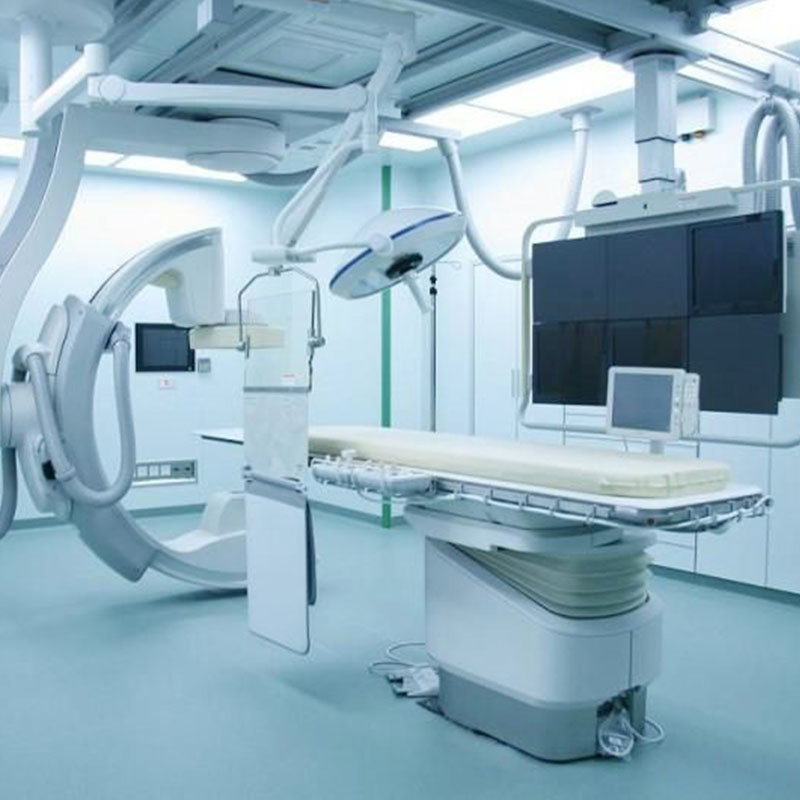
举个例子
1.直接接触:最初的包装材料,如药品分配器、人造乳房、导管等。
2.第二步。无直接接触:如输液器、输血器、注射器等初始包装材料。
5.按规定工艺或无菌操作工艺加工的无菌医疗器械(含医用材料),应在当地10000级以下的100级洁净室(区)内进行生产。
举个例子
1.如血袋生产中的抗凝剂和维持液的灌装、无菌制剂和液体产品的灌装等。贵州省医疗器械GMP洁净室清洁度要求[标准]
2.第二步。血管支架的压力与应用。
评论:
无菌医疗器械包括通过最终灭菌或无菌处理技术使产品不含任何活微生物的医疗器械。
在无菌医疗器械生产中,应采用尽量减少污染的生产工艺,以保证医疗器械不受污染或有效消除污染。
无菌性:产品中没有活的微生物。贵州洁净室设计
灭菌:鉴定微生物的过程,用于使产品没有任何形式的活性。贵州省医疗器械GMP洁净室清洁度要求[标准]
无菌加工:在受控环境下对产品进行无菌制备和无菌灌装。对环境的供气、材料、设备和人员进行控制,使微生物和颗粒物污染控制在可接受的水平。贵州净化工程
无菌医疗器械:指任何标有“无菌”字样的医疗器械。
注:清洗车间必须包括卫生洁具室、洗衣房、临时储藏室、工作站设备清洗间等。
净化条件下生产的产品:指最终使用时需要灭菌或灭菌的产品。